研究人员解开了极简植物免疫分子如何被激活的谜团
在《自然》杂志上发表的一项新研究中,由中国西湖大学的柴继杰和德国科隆马克斯·普朗克植物育种研究所的 Jane Parker 和 Paul Schulze-Lefert 领导的研究人员证明,一类重要的免疫蛋白必须凝结成液滴才能被激活并保护植物免受感染。
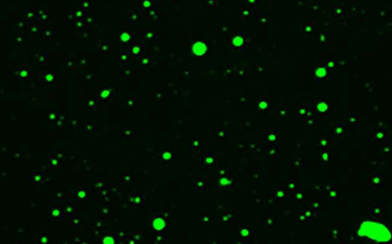
科学家们着手探索一类被称为 Toll/白细胞介素-1 受体 (TIR) 核苷酸结合富含亮氨酸重复序列 (NLR) 受体 (TNL) 的植物免疫受体是如何被激活的。TNL 是由 TIR 结构域(一种古老的蛋白质)的存在来定义的模块,在细菌和哺乳动物的免疫中发挥作用,但为了激活,它们通常依赖于识别来自入侵病原体的分子的其他结构域。
TIR 结构域充当酶并消耗宿主细胞中对能量代谢很重要的底物。激活的 TNL 通常会在尝试感染的部位引发细胞死亡,作为保护整个植物的保护反应。
除了典型的 TNL 之外,植物还具有缺乏识别入侵者的元素的 TNL,同时保留促进细胞死亡和保护植物免受感染的能力。尽管众所周知,这些被称为 TIR 结构域蛋白的截短 TNL 在被其底物激活时喜欢彼此相互作用,并且一旦激活,它们就会充当酶来传播免疫反应酶,但这种情况如何精确发生仍然未知。
研究人员现在发现,随着植物细胞内 TIR 结构域蛋白浓度的上升,它们会像水中的油滴一样分离出来(这是蛋白质相互作用的典型特征),从而触发免疫相关的细胞死亡反应。此外,这些结构不是静态的,TIR 结构域蛋白不断进出液滴。
通过酶组装体的浓缩和组织,相分离是提高酶活性的有效方法。形成这种缩合物对于动物免疫蛋白来说很常见,尽管众所周知这种现象对植物免疫反应很重要,但尚不清楚原因。
除了对植物免疫分子如何激活的基本了解之外,基于相分离的TIR结构域蛋白激活机制的发现可能对科学家理解植物免疫的不同分支如何相互影响产生影响。
共同通讯作者 Schulze-Lefert 对大型蛋白质复合物中 TIR 结构域不同组装的多样性着迷。“令人惊奇的是,进化过程不断地找到方法,赋予植物、动物和细菌中古老的 TIR 蛋白质结构新的生化特性,而这些特性对于免疫系统的稳健性至关重要。”
免责声明:本答案或内容为用户上传,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。 如遇侵权请及时联系本站删除。
