科学家开发出新方法来探究组织特异性蛋白质 蛋白质相互作用
多细胞生物,如动物和植物,具有功能多样的复杂细胞。这种复杂性源于细胞需要产生相互作用的不同蛋白质。这种相互作用对于细胞执行其特定任务和形成复杂的分子机制至关重要。
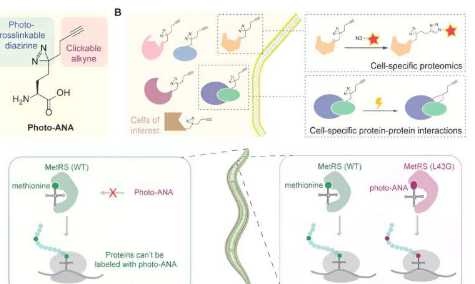
然而,我们目前对此类蛋白质-蛋白质相互作用的理解往往缺乏细胞背景,因为它们通常是在体外系统或从组织环境中分离出来的细胞中进行研究的。以组织特异性方式研究蛋白质-蛋白质相互作用的有效方法在很大程度上是缺失的。
为了弥补这一技术差距,香港大学的一个合作研究团队最近开发了一种新颖的化学生物学方法,该团队由理学院化学系李翔教授和生物科学学院郑朝古教授领导,以及李嘉诚医学院生物医学学院鲍秀聪博士。
该团队利用双功能氨基酸探针标记特定细胞中的蛋白质,这种探针可以分离标记蛋白质,并通过光交联捕获蛋白质 - 蛋白质相互作用。
这种新方法,基于蛋氨酸类似物的细胞特异性蛋白质组学和相互作用组学(MACSPI),使团队能够识别许多新的组织特异性蛋白质和蛋白质相互作用,帮助我们更好地了解细胞在生物体中的工作方式并研究各种生物学问题,例如器官发育和疾病发病机制。
该项研究成果最近发表在美国科学院院刊上。
创新设计
该团队设计并合成了一种非天然氨基酸(photo-ANA),其结构与天然存在的氨基酸蛋氨酸相似,但含有两个额外的成分。
其中一个组分是炔烃基团,可以作为标记蛋白质提取和纯化的化学手柄。另一个组分是二氮杂环丙烷基团,可以通过光激活,在标记蛋白质和与其相互作用的任何分子之间建立稳定的共价键。
接下来,该团队设计了一种名为 MetRS 的酶,以创建一种变体,该变体可以在蛋白质构建过程中识别并将非天然氨基酸整合到蛋白质中。通过控制这种工程酶在特定组织中的表达,只有来自目标组织的蛋白质才会被化学探针标记。此外,通过光诱导交联,可以捕获和分离来自特定组织的蛋白质复合物。
作为概念验证,研究小组应用 MACSPI 方法分别对一种名为秀丽隐杆线虫的模型生物中的肌肉细胞和神经元的蛋白质进行分析,并发现了许多新的组织特异性蛋白质。
研究小组还通过识别普遍表达的蛋白质(如分子伴侣 HSP90)的组织特异性相互作用物,证明了该方法在捕获组织特异性蛋白质-蛋白质相互作用方面的实用性。研究发现,HSP90 可与不同的蛋白质组结合,以调节肌肉和神经元中的不同生物过程。
“这项研究是创新化学标记方法如何帮助解决困难的生物学问题的一个极好的例子,”Xiang David Li 教授说。
“从细胞层面理解蛋白质-蛋白质相互作用通常对于阐明病理过程的分子机制至关重要。例如,我们目前正在探索我们鉴定出的神经元 HSP90 相互作用蛋白的功能;其中一些似乎与帕金森病模型中的神经退行性有关,”郑朝古教授说。
研究团队设想,MACSPI 方法可用于许多多细胞生物,以空间和时间特异性地分析蛋白质组和相互作用组,从而促进广泛的生物和生物医学研究。
免责声明:本答案或内容为用户上传,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。 如遇侵权请及时联系本站删除。
